1 伦理审查申请/报告的类别
1)初始审查
初始审查是指研究者在研究开始实施前首次向伦理委员会提交的审查申请。
2)复审
复审包括再审、修正案审查、年度/定期跟踪审查、安全性事件报告、方案偏离审查、暂停和/或终止研究审查、研究再启动审查、结题审查等。
(1)再审:按伦理审查意见“修改后批准/修改后再审”,对方案等进行修改后,以“再审申请”的方式再次送审;如果对伦理审查意见由不同看法,可以“再审申请”的方式申诉不同意见。
(2)修正案审查:研究过程中若变更主要研究者,对临床研究方案、知情同意书、招募材料等的任何修改,应向伦理委员会提交修正案审查申请,经批准后执行。为避免研究对受试者的即刻危险,研究者可在伦理委员会批准前修改研究方案,事后应将修改研究方案的情况及原因,以“修正案审查申请”的方式及时提交伦理委员会审查。
(3)跟踪审查:应按照伦理审查意见规定的跟踪审查频率,在截止日期前1个月提交研究进展报告;当出现任何可能显著影响研究进行、或增加受试者危险的情况时,应以“研究进展报告”的方式,及时报告伦理委员会。如果在伦理审查意见有效期范围内还未启动试验,应通过“研究进展报告”申请延长有效期。
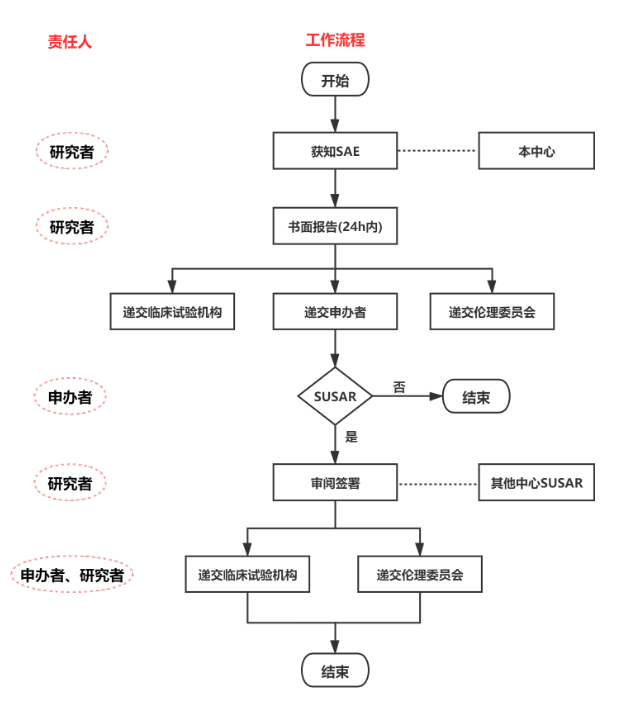
(4)安全性报告:除试验方案或其他文件(如研究者手册)中规定不需立即报告的严重不良事件(SAE)外,研究者应当立即(24小时内)向申办者和伦理委员会书面报告所有SAE,随后应当及时提供详尽、书面的随访报告。
研究者收到申办者提供的临床试验的相关安全性信息后应当及时签收阅读,并考虑受试者的治疗,是否进行相应调整,必要时尽早与受试者沟通,并应当向伦理委员会报告由申办方提供的可疑且非预期严重不良反应(SUSAR)。对于致死或危及生命的非预期严重不良反应,申办者应在首次获知(申办者首次获知当天为第0天)7日内报告,在随后的8日内报告、完善随访信息。对于非致死或危及生命的非预期严重不良反应,申办者应在首次获知15日内报告。研究者审阅申办者提供的个例SUSAR报告后,应在3日内向伦理委员会报告。
作为阶段性的安全性汇总,申办者需要将研发期间安全性更新报告(DSUR)有关信息上报给药监局和卫健委,同时反馈给研究者审阅,研究者审阅后签署伦理委员会递交信,同 DSUR一并递交至伦理委员会审查,至少一年报告一次。
对于医疗器械,在临床试验中出现严重不良事件的,研究者应当立即对受试者采取适当的治疗措施;同时,研究者应当在获知严重不良事件后24小时内,向伦理委员会报告,随后应当及时提供详尽、书面的随访报告。申办者应当在获知死亡或者危及生命的临床试验医疗器械相关严重不良事件后7日内、获知非死亡或者非危及生命的试验医疗器械相关严重不良事件和其他严重安全性风险信息后15日内,向伦理委员会以及主要研究者报告。
其他安全性事件如妊娠事件等也通过安全性信息报告伦理。
(5)方案偏离审查:
①重要方案偏离:增加受试者风险或者显著影响临床试验实施的改变;严重影响受试者的权益、安全和健康,或研究数据的完整性、精确性、可靠性;为避免研究对受试者的即刻危险的方案偏离等,应该及时报告伦理委员会(15日内)。
②一般方案偏离:没有严重影响受试者的权益、安全和健康,建议以年度报告或进展报告形式定期汇报给伦理委员会。
③某些情况下,研究者无法及时判断识别方案偏离的分级分类(如是否重要方案偏离),应在与申办方沟通后尽快报告给伦理委员会(30天)。
(6)中止、暂停和/或终止研究审查:研究者/申办者中止、暂停或终止临床研究,应及时向伦理委员提交暂停/终止研究报告。
(7)研究再启动审查:针对已暂停或监督管理机构发补的研究,需继续开展时,应向伦理委员会提交申请,经审查同意后方可开展。
(8)结题审查:完成临床试验,应及时向伦理委员会提交“结题报告”。


